Afin d’assurer leur survie, la majorité des êtres vivants, des bactéries à l’homme, disposent de systèmes de défense. Ces systèmes se sont empilés et complexifiés au cours de l’évolution du vivant.
Chez l’homme, il existe une ligne de défense immunitaire dite immédiate ou innée et un type de défense immunitaire à mémoire. C’est ce dernier type de défense qui est concerné par la vaccination, que le vaccin soit de type « classique » ou à ARN messager.
Les systèmes de défense des êtres vivants
Chez les êtres unicellulaires : l’exemple des bactéries
Plusieurs équipes de scientifiques ont découvert que les bactéries disposaient de ciseaux moléculaires (Cas) permettant de découper l’ADN des bactériophages (virus prédateurs de bactéries). Après coupure, certains fragments de l’ADN viral sont intégrés dans des zones particulières de l’ADN bactérien (CRISPR) pour constituer une bibliothèque génétique. Il s’agit d’un système immunitaire à mémoire.
https://pubmed.ncbi.nlm.nih.gov/11952905/
https://science.sciencemag.org/content/315/5819/1709
Quand une nouvelle attaque a lieu, l’ADN viral est tout de suite reconnu et découpé. De plus, la résistance bactérienne acquise se transmet aux cellules filles. Ce système est présent dans 30 à 40% des bactéries.
https://www.medecinesciences.org/en/articles/medsci/pdf/2018/10/msc180132.pdf
A partir de ce système de défense bactérien, la française Emmanuelle Charpentier et l’américaine Jennifer A. Doudna ont mis au point des ciseaux moléculaires (CRISPR/Cas9) programmables à l’aide d’un ARN de synthèse servant de guide. Cet outil permet de modifier avec une extrême précision les séquences d’ADN dans tout type de cellule vivante.
https://science.sciencemag.org/content/337/6096/816.long
Le prix Nobel de chimie leur a été décerné en octobre 2020.

Chez les êtres multicellulaires
Chez l’homme, la première défense contre les agressions extérieures est constituée par la peau et par les muqueuses qui tapissent les organes creux (muqueuse digestive, respiratoire, etc.).
Lorsque cette première barrière est franchie, il y a intervention du système immunitaire. On appelle système immunitaire l’ensemble des cellules, tissus et organes qui assurent la défense d’un organisme contre les substances étrangères ou qu’il reconnaît comme telles. Il peut en effet intervenir contre ses propres cellules lorsqu’elles sont infectées par des virus ou lorsqu’elles se développent de manière anarchique, comme les cellules cancéreuses.
Toute molécule considérée comme étrangère par le système immunitaire constitue un antigène.
Dans le règne animal, le système immunitaire a évolué et s’est complexifié durant 800 millions d’années. Pour l’essentiel, le système immunitaire humain est issu de gènes (séquences d’ADN) déjà présents chez les poissons primitifs il y a 600 millions d’années.
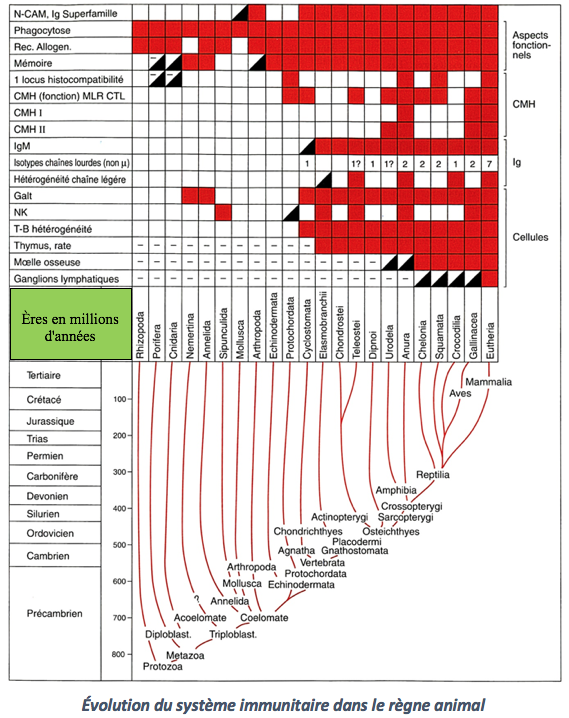
http://www.ipubli.inserm.fr/bitstream/handle/10608/4432/MS_1991_7_665.pdf?sequence=1
Examinons cet arbre évolutif plus en détail :
Déplaçons-nous de gauche à droite, en partant des protozoaires (Protozoa) qui sont des organismes unicellulaires possédant un noyau, pour aboutir aux mammifères (Mammalia). Chaque case rouge correspond à un élément bien défini du système immunitaire.
Prenons pour exemple la phagocytose; les cases sont remplies en rouge sur toute la ligne. Il s’agit d’un même processus qui permet l’ingestion de bactéries par un protozoaire ou par un « globule blanc » humain. Ce premier système de défense est utilisé dans tout le règne animal et se met en place très rapidement lors de l’intrusion d’un élément étranger. En immunologie, il est qualifié de réponse immunitaire immédiate.
Plaçons nous maintenant au milieu de l’arbre évolutif, au niveau des vertébrés (Vertebrata) et considérons les poissons à mâchoire (Gnathostomata). En remontant la colonne correspondante de bas en haut, on voit apparaître une case rouge en face de thymus et d’IgM (Immunoglobuline M). Il s’agit là d’un tournant fondamental dans l’évolution du système immunitaire avec l’apparition du thymus, organe assurant le développement des cellules T. Dans l’organisme humain ces cellules T détruisent les cellules infectées par un virus ou les cellules cancéreuses considérées comme étrangères.
Cette deuxième étape immunitaire est plus longue à se mettre en place au cours de l’infection mais permet à l’organisme de se constituer une « mémoire » des éléments étrangers qui l’ont agressé. Cette mémorisation peut se faire à partir de la contamination par un virus vivant ou par la vaccination. En immunologie, elle est qualifiée de réponse immunitaire adaptative et ne se transmet pas à la descendance.
Nous verrons ultérieurement qu’il existe une collaboration entre les acteurs de la réponse immédiate ou innée et de la réponse adaptative.
Continuons notre progression vers la droite de l’arbre évolutif. Nous voyons apparaître des cases rouges avec l’accolade CMH, abréviation désignant le Complexe Majeur d’Histocompatibilité.
Que signifie cette appellation?
Complexe :
Il s’agit d’un ensemble de plusieurs centaines de gènes (séquences d’ADN) positionnés, chez l’homme, sur le petit bras du chromosome 6.
Majeur :
Désigné ainsi, car lors de sa découverte, il est apparu comme un acteur Majeur dans le rejet des greffes.
Histocompatibilité :
Le CMH fût mis en évidence chez la souris par les américains Baruj Benacerraf et Georges Snell.
Chez l’homme, ce système fut découvert par le français Jean Dausset, dans les années 50, à partir des globules blancs ou leucocytes. C’est pourquoi le CMH humain est souvent désigné par l’abréviation anglaise HLA (Human Leukocyte Antigen).
Tous trois reçurent le prix Nobel de physiologie ou médecine en 1980 « pour leurs découvertes concernant les structures présentes à la surface des cellules qui régulent les réactions immunitaires ».

Chez l’homme, le CMH dit de classe I permet au système immunitaire de faire la distinction entre ses propres cellules et les cellules qui lui sont étrangères. Cette fonction de reconnaissance est assurée par la présence de marqueurs à la surface de toutes les cellules de l’organisme, à l’exception des « globules rouges » ou hématies. Ces marqueurs constituent une véritable carte d’identité biologique et sont différents d’un individu à l’autre, sauf chez les jumeaux vrais issus du même œuf.
En police scientifique, des marqueurs du CMH furent analysés jusqu’au milieu des années 90 afin d’identifier des individus .
Le fœtus : un greffon sans rejet
Dans ce contexte de distinction entre éléments étrangers et éléments propres à l’individu, il était difficile de comprendre pourquoi le fœtus était toléré au cours de la grossesse alors que la moitié des gènes proviennent du père. D’un point de vue tissulaire, le fœtus correspond à un greffon.
Ce paradoxe fût résolu par Edgardo D. Carosella et son équipe. Français d’origine argentine, il rejoint l’Institut universitaire d’hématologie à l’hôpital Saint Louis en 1976. Au début des années 90, il s’intéresse aux marqueurs du système HLA qui permettraient de protéger le fœtus vis à vis du système immunitaire maternel.

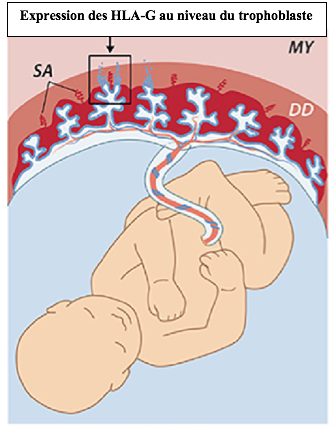
Carosella et ses collaborateurs découvrent la présence d’une molécule particulière qu’ils nomment HLA-G à la surface d’une membrane placentaire (le trophoblaste) entourant l’embryon. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC43754/pdf/pnas01132-0116.pdf
Le système HLA-G correspond à une combinaison de protéines qui inhibent l’action des cellules tueuses du système immunitaire maternel. L’absence de ces protéines protectrices HLA-G entraîne irrémédiablement le rejet du fœtus.
Ce système de protection est particulièrement performant et permet la migration de cellules fœtales porteuses de molécules HLA-G vers la peau de la mère.
Ces cellules fœtales ont pu être mises en évidence 27 ans après l’accouchement. Comme l’indique Edgardo Carosella, la mère conserve toute sa vie des cellules de ses enfants.
Cellules tumorales et HLA-G
Dans une cellule tumorale, l’expression des gènes intervenant dans la régulation cellulaire est altérée. Des gènes s’expriment et sont notamment traduits en ARN messager alors qu’il ne le devrait pas. De ce fait, des protéines propres à chaque type de tumeurs vont être synthétisées. Ces protéines vont être considérées comme des antigènes par le système immunitaire et cette identification va entraîner la destruction des cellules cancéreuses, également appelée cytolyse tumorale.
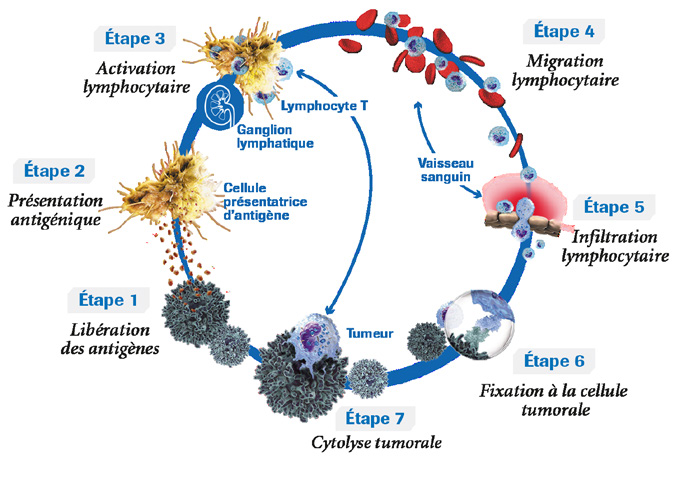
La réponse immunitaire anti-tumorale peut cependant être contournée de plusieurs façons.
Ainsi, dès la fin des années 90, Edgardo Carosella et son équipe mettent en évidence des molécules HLA-G dans des cellules de mélanome. https://www.sciencedirect.com/science/article/abs/pii/S1044579X98901043?via=ihub
Comme dans le cas des cellules fœtales, les molécules HLA-G présentes dans les tumeurs inhibent les cellules tueuses. Ainsi, la tumeur va échapper à la surveillance immunitaire et se développer.
Durant ces 20 dernières années, ces molécules HLA-G ont été découvertes dans un grand nombre de tumeurs. https://bmccancer.biomedcentral.com/articles/10.1186/s12885-020-07113-8
Formation et présentation des antigènes dans les cellules tumorales ou infectées par un virus
Au cours des années 70, l’australien Peter Doherty et le suisse Rolf Zinkernagel découvrent que le complexe majeur d’histocompatibilité de type I (CMH I) n’est pas seulement un marqueur d’identité mais joue un rôle fondamental dans la destruction des cellules infectées par un virus.
Cette découverte aura des implications très importantes dans le domaine de l’immunologie et de la cancérologie.
Ils obtiendront le prix Nobel de physiologie ou médecine en 1996.

Considérons le schéma ci-dessous pour illustrer ces travaux :
Après infection, les protéines du virus cheminent dans un cylindre, appelé protéasome, où des ciseaux moléculaires les découpent en peptides, constitués de quelques acides aminés. Ce sont ces peptides qui constituent l’antigène viral au sein des cellules.
Toujours à l’intérieur de la cellule, les ARN messagers issus du CMH I vont permettre la synthèse de petits « présentoirs » ici en bleu au bas du schéma. L’antigène viral figuré par un cercle jaune se fixe alors sur le présentoir et l’ensemble migre à la surface de la cellule comme indiqué par la flèche incurvée.
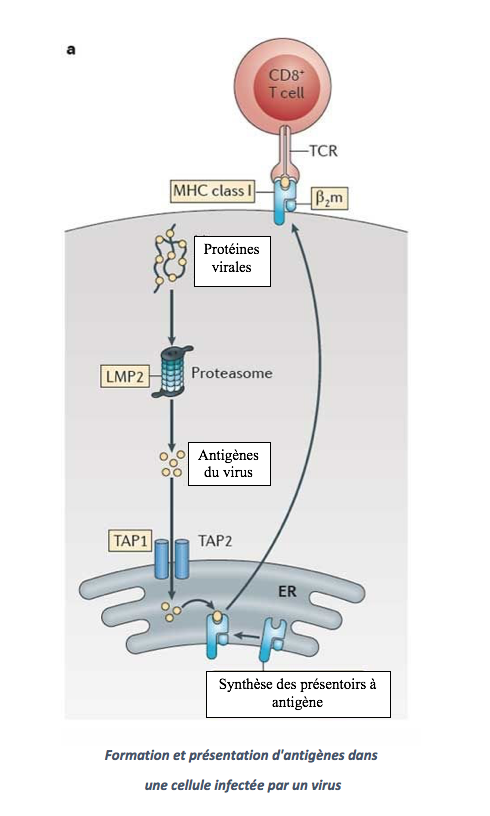
Dans le cas d’une cellule tumorale, le processus est identique mais les protéines virales sont remplacées par des protéines anormalement présentes au sein de la cellule cancéreuse.
Lorsque le complexe antigène-présentoir MHC I atteint la périphérie cellulaire il est repéré par un « globule blanc » dénommé lymphocyte TCD8+. Ces lymphocytes sont très spécialisés et ne reconnaissent que les cellules tumorales ou les cellules infectées par un virus, via leurs antigènes spécifiques. Ces lymphocytes TCD8+ donnent naissance à des clones qui se divisent en cellules tueuses (lymphocytes cytotoxiques) ou en cellules mémoire (lymphocytes mémoire).
Ces processus ne se déroulent que si le système immunitaire fonctionne normalement et qu’il n’y a pas d’évitement de type HLA-G comme précédemment décrit pour les cellules tumorales.
Très pédagogique, y compris pour les néophytes qui n’ont aucune connaissance médicale.
J’aimeJ’aime
Merci pour cet article détaillé et très intéressant ! :)
J’aimeJ’aime