Au début des années 90, les connaissances accumulées au cours des décennies précédentes sur l’ARN messager et la mémoire immunitaire permirent d’envisager une approche plus rationnelle et plus rapide dans la conception de nouveaux vaccins.
Beaucoup d’antigènes microbiens étant constitués de protéines, il parut judicieux de fournir directement à notre organisme l’information nécessaire pour synthétiser ces antigènes afin de créer une mémoire immunitaire.
Pour ce faire, il « suffisait » d’inclure cette information dans un ARN messager et de la transmettre à la machinerie cellulaire qui assure en permanence la synthèse de toutes nos protéines.
L’exercice s’avéra plus délicat que prévu et dura une trentaine d’années.
Synthèse d’ARN messagers in vitro à partir d’ADN modifié
Vaccins Pfizer/BioNTech et Moderna
Dès le début des années 90, plusieurs équipes de scientifiques s’attelèrent à la production de vaccins à ARN messager sans passer par le biais d’un transporteur viral.
Dans ce cas, la phase de production de l’ARN messager à partir de l’ADN se fait uniquement en laboratoire et seul l’ARN messager obtenu est injecté.
S’agissant des vaccins anti-coronavirus, la première étape consiste à insérer un gène correspondant au spicule du coronavirus dans un ADN circulaire ou plasmide.
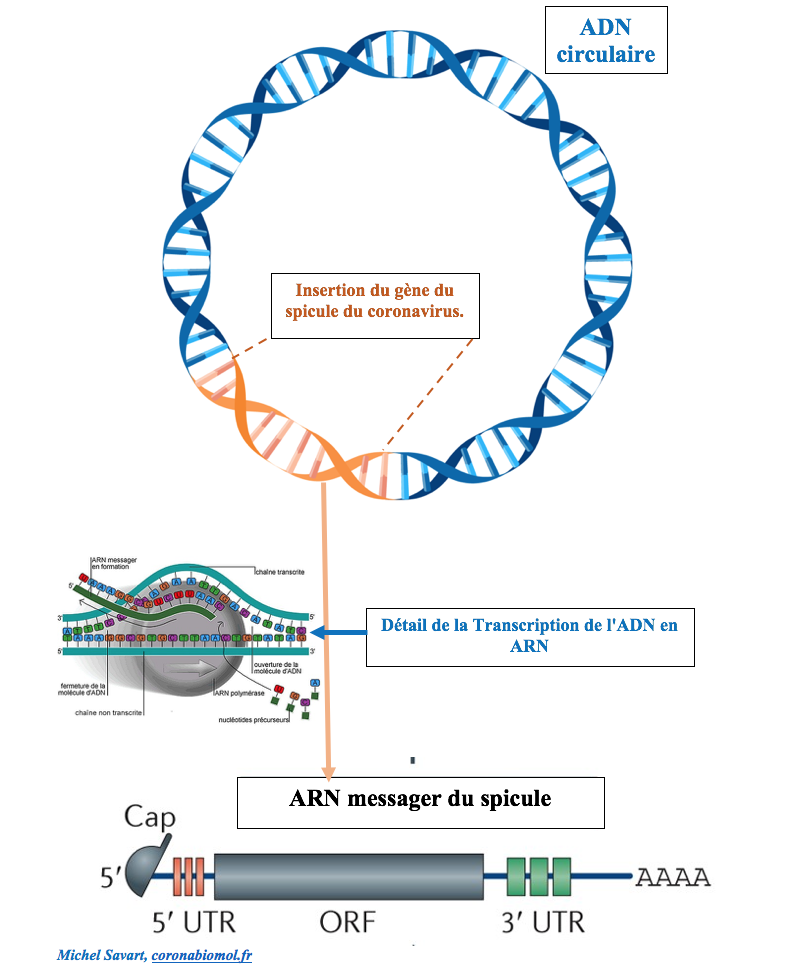
Une ARN polymérase parcourt l’ADN modifié et synthétise un brin d’ARN messager complémentaire du gène inséré (en utilisant U à la place de T). En prévision de leur captation dans les cellules cibles, les ARN messagers synthétisés sont dotés d’une coiffe (Cap) qui les protègera d’une coupure éventuelle par des ciseaux moléculaires à ARN (ribonucléases) et initiera la traduction en protéines par les ribosomes. La queue AAAA… joue également un rôle dans la stabilité de ces ARN messagers.
La partie grisée marquée ORF porte l’information strictement nécessaire à la synthèse du spicule.
Une fois la transcription in vitro terminée, l’ADN est coupé à l’aide de ciseaux à ADN (Dnases) et les ARN messagers obtenus sont purifiés.
Protection des ARN messagers et pénétration cellulaire
Cependant, il n’était pas possible d’injecter directement de l’ARN messager « nu » chez un individu pour deux raisons principales.
1) Le courant sanguin contient des ciseaux moléculaires à ARN (ribonucléases) et de ce fait les ARNs sans protection sont rapidement dégradés.
2) Les ARNs possèdent un squelette sucre-phosphate sur lequel sont fixées les bases A,U,G,C. Or, les phosphates portent des charges électriques négatives de même que les membranes cellulaires.
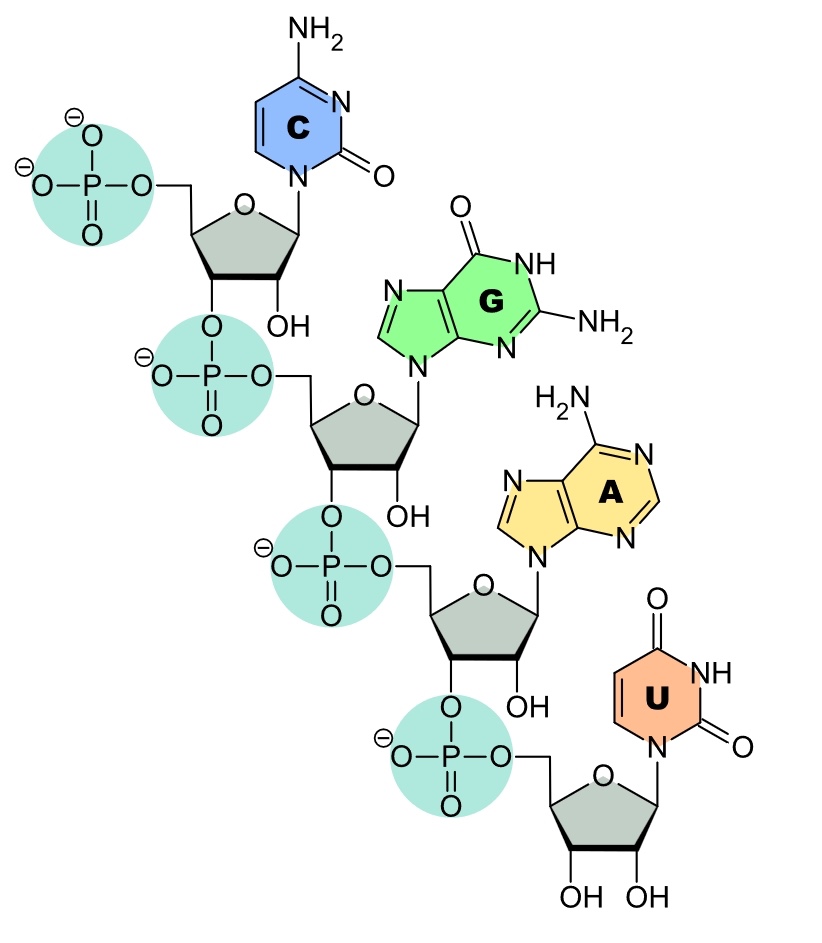
Fragment d’ARN messager chargé négativement
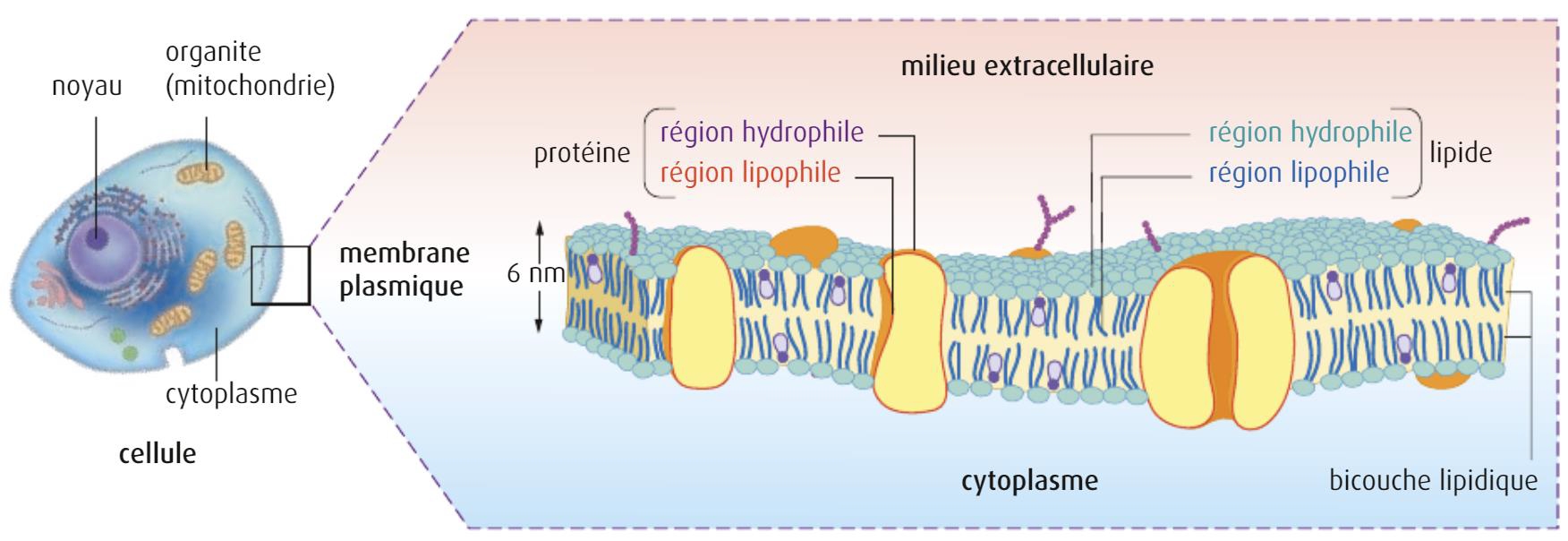
Membrane cellulaire chargée négativement
Il fallait donc trouver un système de protection de l’ARN vis à vis des ribonucléases (les ciseaux à ARN) qui soit aussi chargé positivement afin de se fixer aux cellules. La solution fut apportée par l’encapsulation des ARN dans des nanoparticules lipidiques chargées positivement.

Un biochimiste canadien de l’Université de Colombie Britannique, Pieter Cullis, fût un des pionniers de ces techniques d’encapsulation lipidique. Il est le co-fondateur de plusieurs start-up impliquées dans ce domaine, notamment de la société Acuitas. La technologie des nanoparticules d’Acuitas est utilisée pour l’encapsulation de l’ARN messager du vaccin COMINARTY mis au point par la société allemande BioNtech et commercialisé sous l’appellation Pfizer/BioNtech.
Nanoparticule lipidique chargée positivement
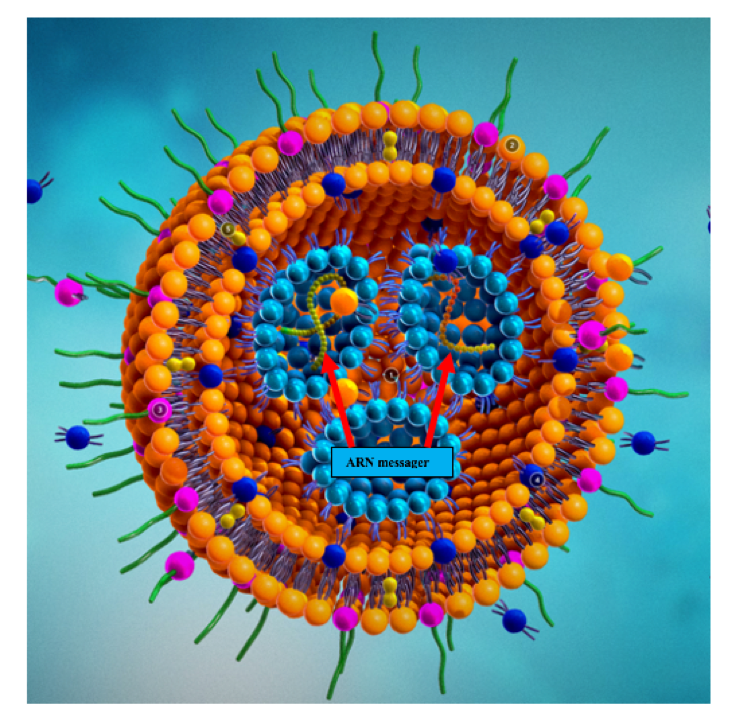
Encapsulation de l’ARN messager, vue interne
Lors d’expérimentations chez l’animal, on put constater que les nanoparticules contenant l’ARN étaient capturées par des vésicules transporteuses, les endosomes, de la même manière qu’avec les adénovirus.
Un premier pas était donc franchi et des résultats préliminaires intéressants furent rapportés chez la souris, mais au cours des essais chez l’homme les ARN messagers étaient détruits et provoquaient une importante réponse inflammatoire. La lecture des messagers par la machinerie de synthèse des protéines (les ribosomes) devenait donc impossible.
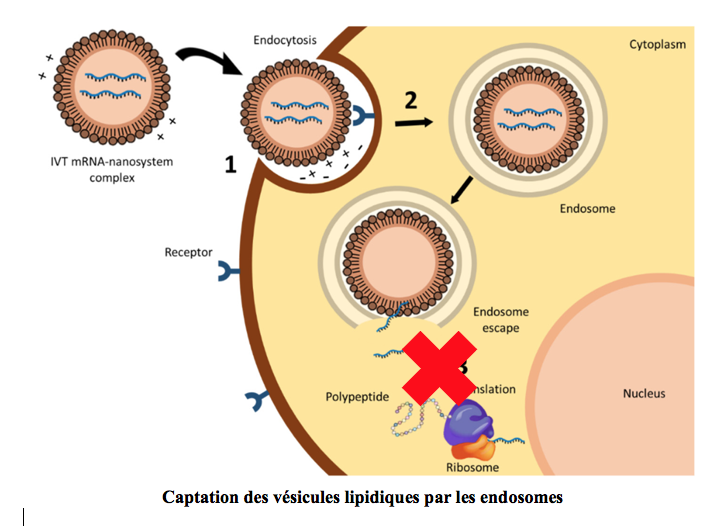
Un obstacle redoutable à surmonter : Le système immunitaire inné
Il fallut comprendre d’où provenait ce blocage et les regards se tournèrent vers le système immunitaire inné.
Nos organismes sont en effet dotés d’un système immunitaire à action immédiate qui se déclenche dès les premières heures suivant une infection. Cette immunité est dite innée car transmissible à notre descendance. Elle s’exerce en l’absence d’anticorps mais fait intervenir d’autres facteurs, les cytokines. Il s’agit de la première ligne de défense contre les microbes chez tous les animaux et elle constitue la seule défense chez les animaux dépourvus de mémoire immunitaire.
Dans les précédents articles sur l’immunité naturelle et la mémoire immunitaire, nous avions vu que cette première ligne de défense reposait sur l’existence de globules blancs particuliers appelés macrophages.
Au cours des années 90 cette immunité innée fût étudiée avec l’aide des outils de la génétique, de la biochimie et de la biologie moléculaire.
Un groupe de chercheurs réunis autour de Jules Hoffmann, à l’Université de Strasbourg, mit en évidence chez la drosophile (la mouche du vinaigre) des récepteurs particuliers intervenant dans la reconnaissance de molécules provenant de différents types de microbes (virus, bactéries, champignons).
Quelques années plus tard, un système équivalent de récepteurs appelés TLRs fut mis en évidence chez les mammifères par l’américain Bruce Beutler et son équipe. https://fire.biol.wwu.edu/cmoyer/zztemp_fire/biol345_S01/immunity99.pdf
Ils reçurent le prix Nobel pour leurs découvertes en 2011, en même temps que Ralph Steinman, le découvreur des cellules dendritiques.

En quoi consiste ce système?
Chez l’homme, ce système est constitué d’une dizaine de récepteurs capables de reconnaitre spécifiquement une classe de molécules essentielles au développement des microbes.
Sur la figure ci-dessous, prenons l’exemple des récepteurs TLRs soulignés en rouge, les récepteurs 7 et 8. Ils fixent de façon sélective les ARN simples brins (ARNsb) dont sont constitués un grand nombre de virus à ARN et les ARN messagers des bactéries.
Pour leur part, les récepteurs TLR3 fixent les ARN double brin (ARNdb) qui présentent la particularité de former une double hélice semblable à celle de l’ADN.
Du fait de l’existence de ce système de reconnaissance, les macrophages et les cellules dendritiques (les cellules présentatrices d’antigènes) peuvent détecter l’ensemble du monde microbien avec seulement une dizaine de types différents de récepteurs.
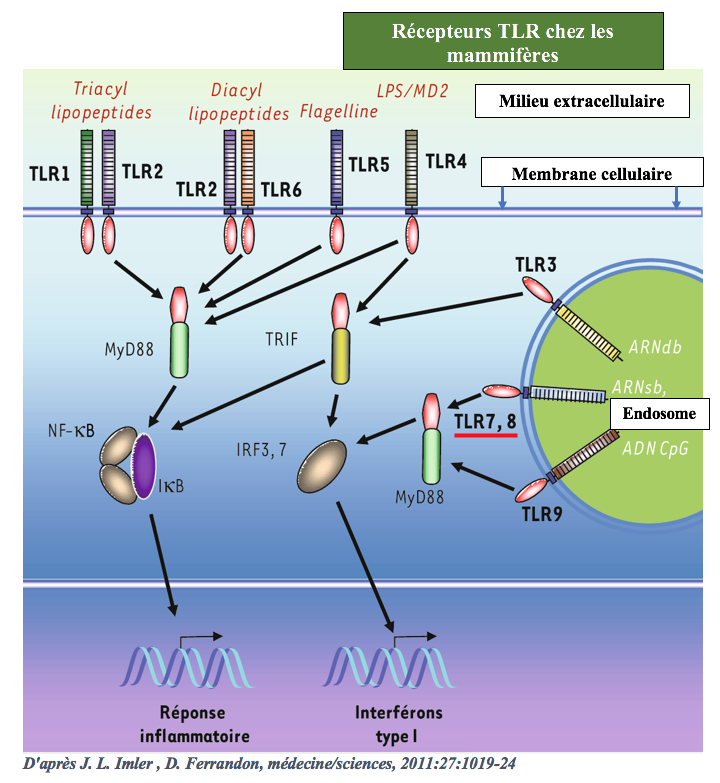
https://www.medecinesciences.org/en/articles/medsci/pdf/2011/09/medsci20112711p1019.pdf
Ainsi, au lieu d’être lu par les ribosomes, l’ARN messager de synthèse se fixait sur les récepteurs TLR 7,8 et déclenchait une réponse inflammatoire se traduisant irrémédiablement par sa destruction.
Comment cet obstacle fut-il surmonté?
Katalin Kariko, une biochimiste et biologiste moléculaire hongroise s’établit à Philadelphie en 1985 pour poursuivre ses recherches sur l’ARN messager. Dans cette ville, elle travaille à l’université Temple puis à l’université de Pennsylvanie où ses travaux suscitent l’intérêt d’un immunologiste, Drew Weissman. Ils travaillent ensemble sur les relations entre ARN messager et récepteurs TLR3, 7 et 8 du système inné.

La question qui se posait était la suivante : Pourquoi les ARN messagers que nous fabriquons en permanence dans nos cellules échappent à la détection du système inné alors que les ARN de synthèse ou d’origine microbienne provoquent une inflammation importante et sont systématiquement détruits?
L’attention de Katalin Kariko et Drew Weissman fut attirée par les résultats de plusieurs équipes de scientifiques montrant que les ARNs des mammifères présentaient des modifications par rapport aux ARNs des virus et des bactéries.
Ils firent l’hypothèse que ces modifications pourraient permettre au système immunitaire inné de différencier les molécules d’origine microbienne de celles propres aux mammifères.
En quoi consistaient ces modifications?
Dans l’article sur le coronavirus nous avons vu que l’ARN était constitué de quatre bases (A,U,G,C), d’un sucre appelé ribose et de groupes phosphate. L’association entre les bases et le ribose est appelée nucléoside.
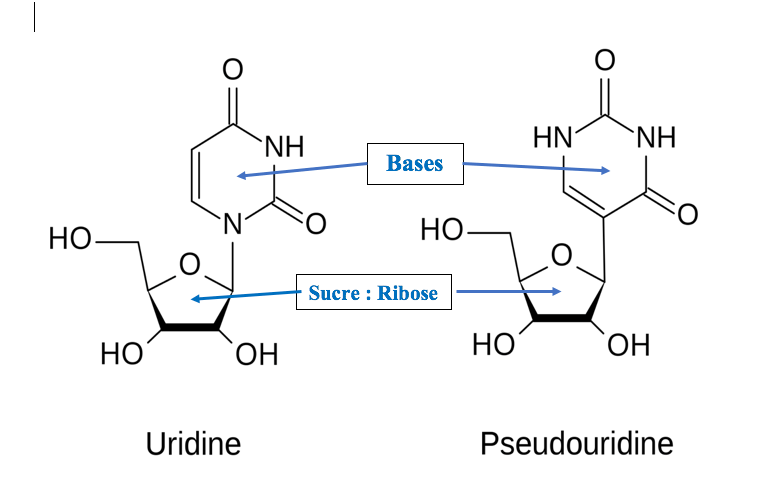
Dans l’exemple ci-dessus, qui représente les nucléosides uridine et pseudouridine, les bases associées au ribose sont légèrement différentes.
Katalin Kariko et Drew Weissman utilisent alors des ARN messagers contenant des nucléosides modifiés semblables à ceux des mammifères et notamment la pseudouridine à la place de l’uridine.
Ils constatent que ces ARN modifiés ne sont pas reconnus par les récepteurs TLR3, 7 et 8, échappant ainsi à la destruction. De plus, le processus inflammatoire est très fortement réduit. Cette découverte permettait de faire sauter le verrou empêchant l’utilisation d’ARN messagers de synthèse.
Katalin Kariko et Drew Weissman publient leurs travaux en 2005 : https://www.cell.com/immunity/fulltext/S1074-7613(05)00211-6
Le prix Nobel de Médecine leur a été décerné le 2 octobre 2023.
De l’ADN modifié à la synthèse du spicule du coronavirus
Dans le cas du vaccin anti-coronavirus, le cheminement menant de l’ADN modifié jusqu’au spicule est présenté ci-dessous : 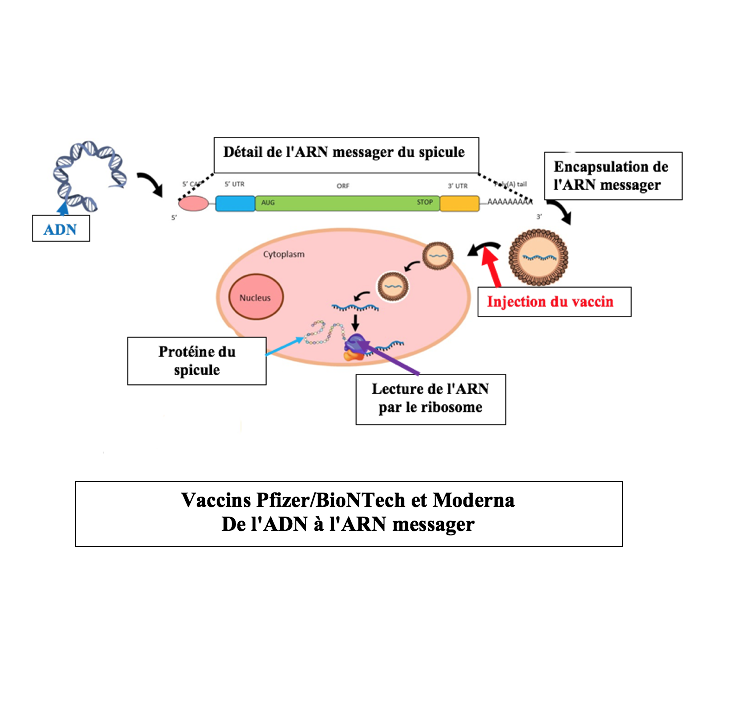
Que ce soit pour les vaccins à adénovirus ou pour les vaccins « dits » à ARN messager il faut souligner que l’on part toujours d’un ADN modifié pour aboutir à un ARN messager.
Il existe cependant des différences majeures. En effet, pour les vaccins dénommés à « ARN messager » :
1) Les étapes menant de l’ADN à l’ARN messager se déroulent en laboratoire, à l’extérieur de l’organisme.
2) Le transport de l’information génétique se fait par l’intermédiaire d’une capsule lipidique au lieu d’une coque (capside) de virus.
3) A la différence de l’adénovirus qui pénètre dans les noyaux cellulaires, les ARN messagers des vaccins Pfizer/BioNTech ou Moderna sont lus directement par les ribosomes lors de leur pénétration à l’intérieur de la cellule. Il n’y a pas de migration vers le noyau cellulaire.
Le process industriel
La transcription d’un gène inséré dans un ADN circulaire pour aboutir à un ARN messager, suivie de la phase d’encapsulation, ne constitue qu’une étape dans le process général de fabrication des vaccins à ARN.
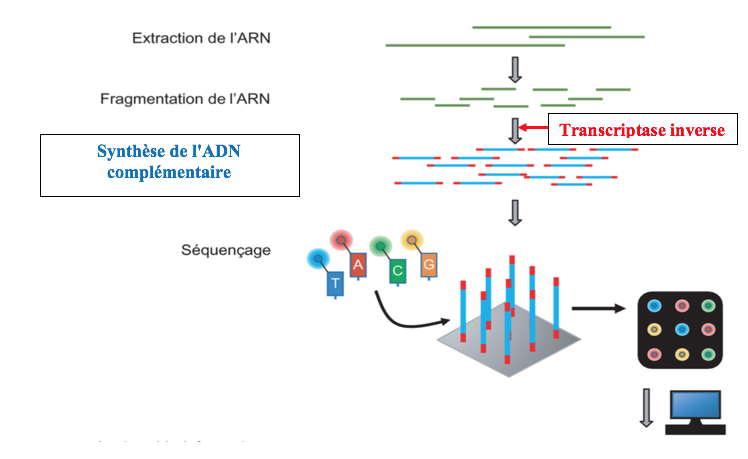
Lors de l’élaboration d’un nouveau vaccin antiviral à ARN messager, il faut au préalable analyser la séquence du virus en question. S’il s’agit d’un virus à ARN, comme le coronavirus SarsCov2, il faut d’abord déterminer la séquence de cet ARN c’est à dire l’ordre d’association entre les bases A,U,G,C. C’est cette même technique de séquençage qui est utilisée dans la traque permanente des mutants du coronavirus.
Pour séquencer le coronavirus, il faut l’extraire de son enveloppe et de sa capside puis le découper en fragments à l’aide de ciseaux moléculaires (Ribonucléases). Chacun de ces fragments d’ARN sert ensuite de matrice à une enzyme particulière appelée transcriptase inverse. Cette enzyme transcrit l’information portée par l’ARN en ADN complémentaire.
Le séquençage de l’ADN complémentaire est ensuite effectué sur une plateforme de séquençage à haut débit.
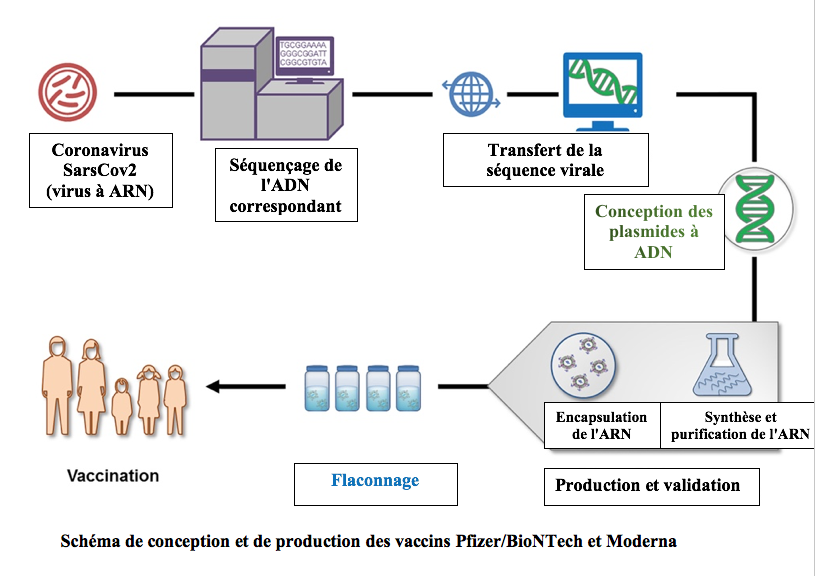
Après cette phase de séquençage il devient possible de concevoir les gènes que l’on va introduire dans les plasmides (ADN circulaire) pour programmer la synthèse des ARN messagers spécifiques.
Après leur production à l’échelle industrielle, les ARN messagers sont séparés des plasmides à ADN qui ont été préalablement découpés. Ces ARN sont ensuite encapsulés dans les nanoparticules lipidiques et conditionnés pour la vaccination.
Dépôt de brevet et licences
En août 2005, les résultats obtenus par Katalin Kariko et Drew Weissman donnent lieu à un dépôt de brevet par l’Université de Pennsylvanie pour la synthèse d’ARNs modifiés à visée thérapeutique.
En décembre 2016, l’université de Pennsylvanie vend la licence du brevet à « mRNA RiboTherapeutics », qui vend ensuite une sous-licence à la société américaine Cellscript.
En 2017, Cellscript signe des accords de sous-sous-licence avec la société américaine Moderna et la société allemande BioNTech.
En droit de la propriété intellectuelle, les licences de brevet se définissent comme le contrat par lequel le titulaire du brevet autorise un tiers, le licencié, à exploiter le brevet en contrepartie d’une redevance.
Collaborations scientifiques, industrielles et commerciales
En 2013, Katalin Kariko rejoint la société allemande BioNTech spécialisée dans la technologie des ARN à visée thérapeutique, fondée par deux chercheurs en médecine moléculaire et oncologie, Ugur Sahin et Ozlem Türeci. Elle en devient la vice-présidente.

Le 17 mars 2020, BioNTech et la firme américaine Pfizer signent un accord de collaboration concernant le développement et la distribution d’un vaccin contre le coronavirus SarsCov2, à base d’ARN messager.
Contact : sarsbiomol@orange.fr