Depuis des temps immémoriaux, l’homme est confronté à de nombreuses épidémies. La peste, le choléra, la variole et le typhus restent profondément ancrés dans notre mémoire collective.

Pieter Bruegel l’Ancien, Le Triomphe de la Mort 1562, Musée du Prado Madrid
Dès l’Antiquité, l’historien grec Thucydide rapporta que des personnes contractant certaines maladies contagieuses en réchappaient et qu’elles étaient peu touchées lors de nouveaux épisodes.
Ce phénomène fût également observé en Orient pour la variole et une méthode de protection fût mise au point en Chine, appelée variolisation. Elle consistait à inoculer le contenu de pustules varioliques dans les narines de jeunes enfants afin de les protéger. Cependant, la pratique restait aléatoire et engendrait un taux de mortalité estimé à 1 ou 2%.

Variolisation en Chine
Au 19ème siècle, parallèlement à l’apparition des premières campagnes de vaccination, les mécanismes intervenant dans la résistance aux maladies contagieuses commencent à être étudiés.
Il faudra près d’un siècle d’efforts et plusieurs générations de scientifiques pour décrypter le fonctionnement du système immunitaire et plus particulièrement de la mémoire immunitaire.
Ces connaissances fondamentales, sans cesse affinées, ont permis le développement spectaculaire de nouveaux types de vaccins et de l’immunothérapie anticancéreuse.
Immunité humorale et anticorps
La mise en évidence de molécules présentes dans le sérum sanguin pour protéger un individu des agressions microbiennes est due à un scientifique allemand, Paul Ehrlich. Vers 1894 il donna le nom de « chaînes latérales » à ces molécules et l’on parla d’immunité humorale.
Le terme « humoral » est toujours en usage. Il remonte à Hippocrate qui désignait sous le terme d’humeurs des fluides liquides du corps.

Paul Ehrlich (1854 – 1915) , Prix Nobel 1908
Paul Ehrlich reçut le Prix Nobel de Physiologie et médecine en 1908 « pour son travail dans le domaine de l’immunité ».
La structure de ces « chaînes latérales », actuellement appelées anticorps, a été élucidée au début des années 60 par l’américain Gerald Edelman et l’anglais Rodney Porter. Ils reçurent le Prix Nobel pour leurs travaux en 1972.

Ils montrèrent que les anticorps ou Immunoglobulines (Ig), sont constitués par l’association de quatre protéines. Deux chaînes légères et deux chaînes lourdes forment une structure de base en forme de Y.
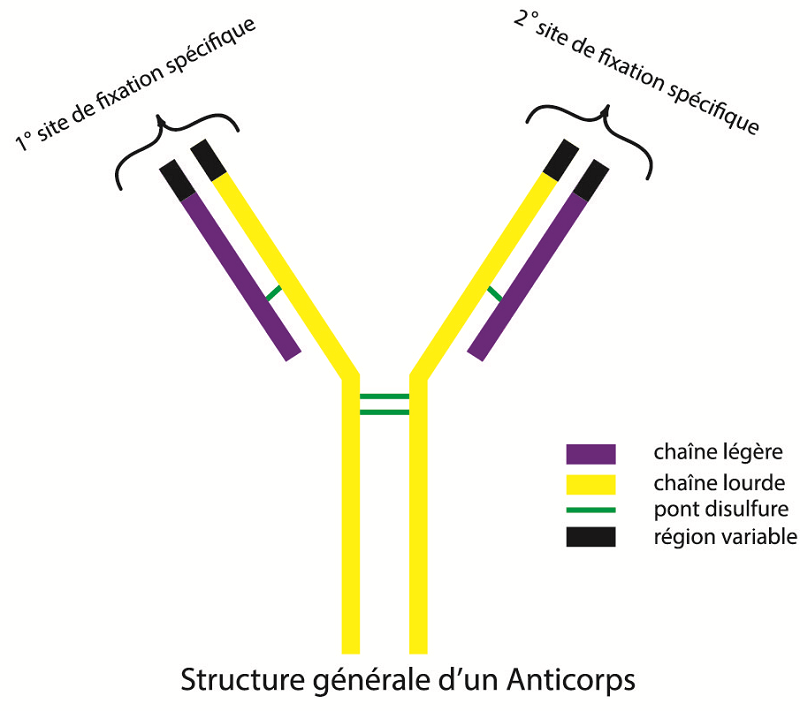
Les anticorps fixent les antigènes à l’extrémité de régions dites variables. Pour rappel, un antigène est une molécule considérée comme étrangère par le système immunitaire. Ces antigènes peuvent provenir d’une infection microbienne ou être générés par des cellules tumorales à l’intérieur de notre propre organisme.
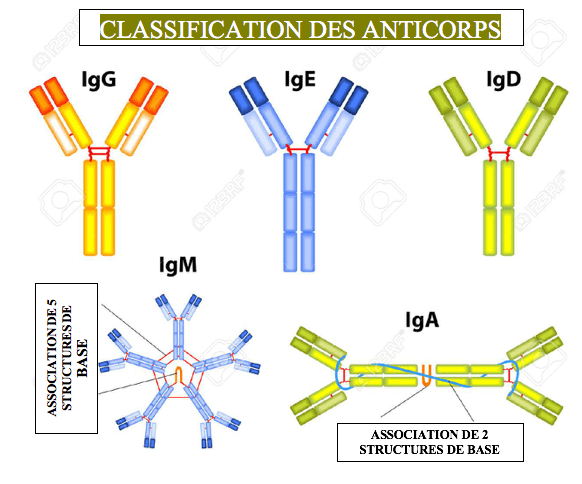
Cinq classes d’anticorps ont été mises en évidence (IgA, IgD, IgE, IgG, IgM), qui diffèrent par la nature de leurs chaînes lourdes et par la façon dont leurs structures de base sont associées.
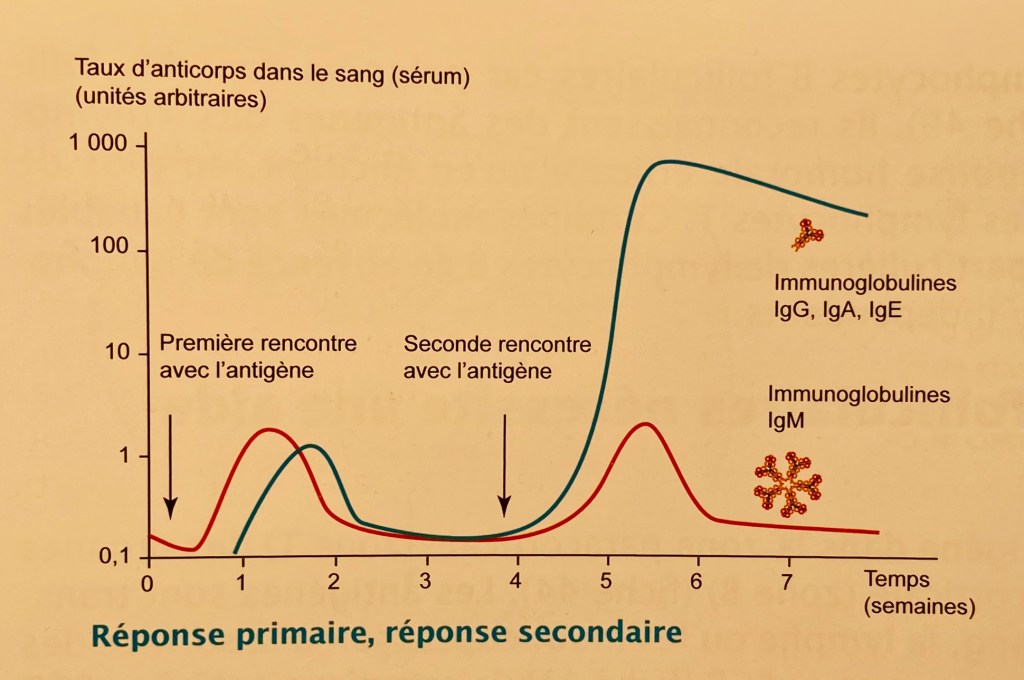
Comme présenté ci-dessous, les taux d’anticorps mesurés dans le sang après une première rencontre avec un antigène sont de type IgM (courbe rouge). Ils sont suivis avec un léger décalage par des anticorps de type IgG, IgA et IgE (courbe verte).
Qu’il s’agisse d’une infection ou d’une vaccination, on observera ce même type de réponse primaire.
F. Gros et al., Atlas d’immunologie, Editions Dunod, 2018
Lors d’une deuxième rencontre avec l’antigène, qu’il s’agisse d’une infection ou d’un rappel de vaccination, on observera un deuxième pic de production beaucoup plus important des IgG, IgA et IgE.
L’immunité cellulaire
En 1883, Ilya Ilitch Metchnikov met en évidence le rôle de « globules blancs » particuliers (les macrophages ou gros mangeurs) dans la défense des organismes animaux en utilisant des larves d’étoiles de mer.
Biologiste d’origine russe, Metchnikov travailla en Russie et dans plusieurs laboratoires européens avant de poursuivre ses recherches à l’Institut Pasteur de Paris. En 1908, il sera colauréat du prix Nobel de Physiologie et Médecine avec Ehrlich « pour son travail dans le domaine de l’immunité ».

Ilya Ilitch Metchnikov (1845-1916), Prix Nobel 1908
Il faut souligner que cette appellation « domaine de l’immunité » recouvrait l’immunité humorale et l’immunité cellulaire. Ces deux approches opposèrent pendant de nombreuses années « cellularistes » et « humoralistes » comme présenté dans cette vidéo : https://www.youtube.com/watch?v=R07Dp9hze30
Le lien direct entre ces deux approches ne fût établi qu’en 1943, par deux chercheurs danois, Mogens Bjørneboe et Harald Gormsen. Après avoir inoculé des vaccins ou des toxines à des lapins, ils observent une stricte corrélation entre la prolifération de globules blancs sanguins et la sécrétion d’anticorps. https://onlinelibrary.wiley.com/doi/abs/10.1111/j.1699-0463.1943.tb05023.x
En 1947, la suédoise Astrid Fagraeus confirme ces résultats. Elle infecte des lapins avec des bactéries et observe que les anticorps produits sont issus de « globules blancs » présents dans la rate. https://www.nature.com/articles/159499a0

Astrid Fagraeus (1913-1997)
Ces deux approches expérimentales permirent de faire le lien entre « globules blancs » et anticorps. Mais quel était l’origine de ces « globules blancs »?
L’étape suivante fût franchie au début des années 60 par Jacques Miller et Max Dale Cooper lorsqu’ils découvrirent l’existence et le rôle joués par des « globules blancs » particuliers, les cellules T et B. https://www.pnas.org/content/pnas/117/1/12.full.pdf
Thymus et cellules T
En 1961, Jacques Miller travaillait à l’institut de recherche sur le cancer de Londres. Il découvrit qu’un organe présent chez les jeunes animaux et les jeunes enfants, jusque-là considéré comme sans intérêt, jouait un rôle fondamental dans l’immunité. Il s’agissait du thymus. https://www.sciencedirect.com/science/article/abs/pii/S0140673661906936
Cet organe, connu depuis des siècles et situé derrière le sternum, était appelé ainsi car ses deux lobes présentent une vague ressemblance avec les fleurs de thym (thymus vulgaris). Il était considéré par certains auteurs comme un petit coussin assurant la protection de la veine cave. Pour d’autres, ce n’était qu’un « cimetière » à globules blancs. Enfin, en termes culinaires, le thymus de veau correspond aux ris de veau.
Thymus humain et thymus vulgaris

Les deux lobes du thymus de veau (Ris de veau)
Miller montra que la présence de cet organe était essentielle au développement de l’immunité à long terme.
Certains « globules blancs » en provenance de la moelle osseuse gagnent le thymus où ils subissent une maturation et se transforment en cellules T, ainsi nommées car présentes dans le Thymus. Après maturation, elles migrent vers les ganglions et la rate.
Cellules B : Les productrices d’anticorps
La bourse de Fabricius a été découverte au 16ème siècle, chez les oiseaux, par le médecin italien Hieronymus Fabricius (1537-1619). Il pensait que la fonction principale de cet organe, situé près du cloaque, était de stocker le sperme d’où l’appellation « bourse ».
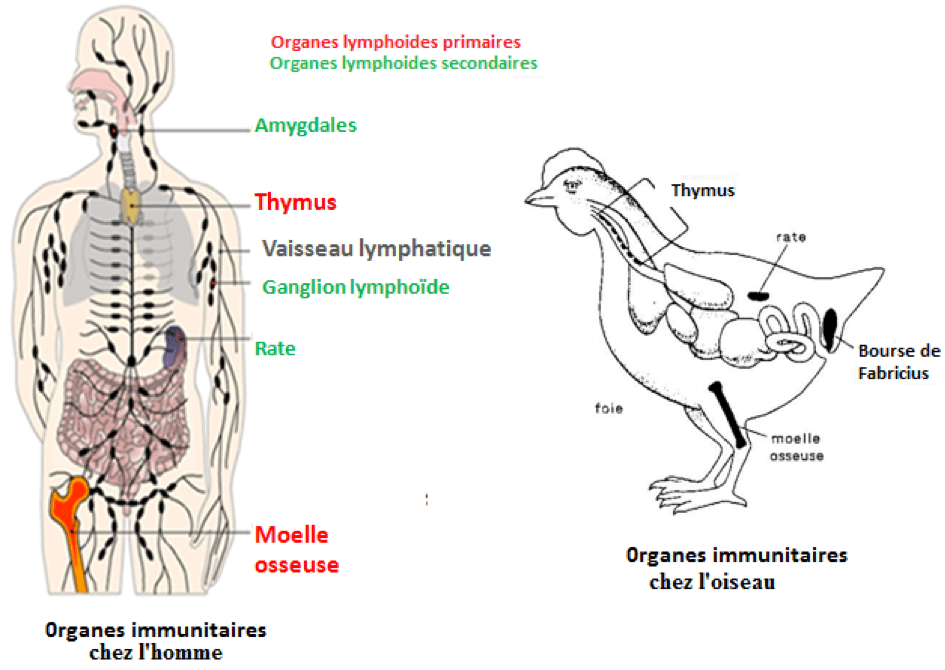
En 1965, un immunologiste américain, Max Dale Cooper, prenant le poulet comme modèle expérimental, constate que les bourses de Fabricius renferment des globules blancs ayant la propriété de produire des anticorps.
Il les nomme lymphocytes B car ils proviennent des Bourses de Fabricius. Ultérieurement ils seront appelés cellules B. https://www.nature.com/articles/205143a0
Ainsi, 71 ans après les observations de Paul Ehrlich sur l’existence d’une « immunité humorale » et suite à une longue série de travaux, les cellules produisant les anticorps étaient caractérisées.
Chez les mammifères, il apparût que des cellules productrices d’anticorps étaient également présentes et provenaient de la moelle osseuse. Il y a équivalence entre la moelle osseuse des mammifères et les bourses de Fabricius des oiseaux quant à la production des cellules B. Bien que les mammifères ne possèdent pas de bourses de Fabricius, l’appellation lymphocytes B ou cellules B a été conservée.
Il faut aussi préciser que les « globules blancs » découverts par Ilya Ilitch Metchnikov en 1883 assurent la première ligne de défense immunitaire. Ils différent donc des lymphocytes B et T qui appartiennent à la deuxième ligne de défense.
En 2019, Jacques Miller et Max Dale Cooper reçurent conjointement le prix Albert Lasker pour leurs découvertes des cellules T et B. (Prix dénommé « Nobel américain » car considéré comme l’antichambre des prix Nobel de Physiologie ou Médecine).

La découverte des cellules B a permis le développement à partir de 1975, par Köhler et Milstein, de la technique des anticorps monoclonaux. Le prix Nobel leur sera décerné en 1984.

L’apport de ces anticorps en thérapeutique et dans les applications diagnostiques sera développé dans un autre article.
Les cellules souches sanguines
A partir de 1960, un biologiste et un physicien canadiens, Ernest A. McCulloch et James E. Till, travaillent de façon complémentaire sur les cellules de moelle osseuse de souris comme présenté dans la vidéo suivante : https://www.youtube.com/watch?v=NAlhldAdT7A

James E. Till (1931) et Ernest A. Mc Culloch (1926-2011),
Université de Toronto, Prix Lasker 2005
Ils découvrent que des cellules souches présentes dans la moelle osseuse sont à l’origine de tous les types de cellules sanguines. Lorsque ces cellules souches sanguines se divisent, leurs cellules filles se différencient en globules rouges, en cellules initiatrices des plaquettes et en différents types de globules blancs.
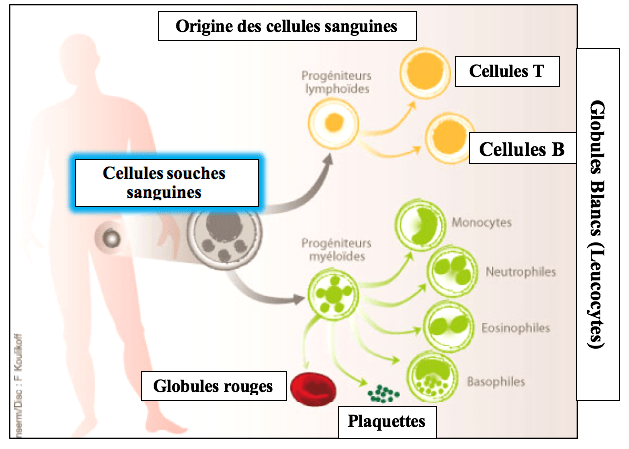
– Globules rouges (Également appelés hématies ou érythrocytes) :
Ils représentent près de 99% des cellules sanguines et servent au transport du dioxygène (O2) et du dioxyde de carbone (CO2).
Un millilitre de sang d’un adulte moyen en contient autour de 5 milliards. Leur durée de vie avoisine 4 mois et la moelle osseuse en produit près de 2 millions par seconde.
Chaque globule rouge peut être considéré comme un sac contenant plus de 250 millions de molécules d’hémoglobine. Chaque molécule d’hémoglobine fixant 4 molécules de dioxygène (O2), il en résulte qu’un seul globule rouge transporte un milliard de molécules de dioxygène.
Chez les mammifères, les globules rouges sont dépourvus d’ADN. L’ADN analysé après prélèvement de traces de sang sur une scène de crime provient donc uniquement des globules blancs, lesquels ne représentent que 1% des cellules sanguines.
– Plaquettes :
Il s’agit de fragments cellulaires provenant de globules blancs présents dans la moelle osseuse. Les plaquettes participent notamment à l’arrêt des saignements lors de la lésion de petits vaisseaux.
– Globules blancs (ou leucocytes) :
Ils ne représentent pas plus de 1% du volume sanguin.
Les globules blancs assurant la première ligne de défense sont représentés en vert dans le schéma précédent.
Les cellules T et B sur lesquelles reposent la mémoire immunitaire sont représentées en jaune.
Si l’on considère l’ensemble du système lymphoïde (Cf. ci-dessous), il apparaît que les précurseurs des cellules B et T proviennent de la moelle osseuse.
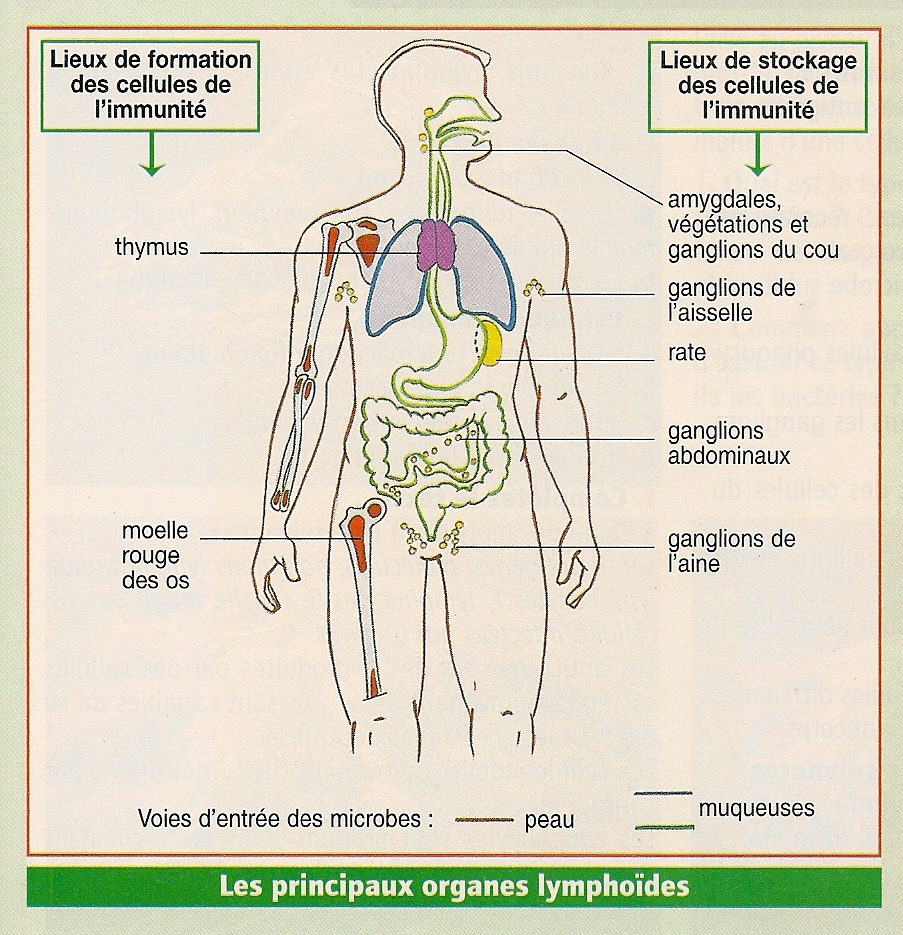
La maturation des cellules B se déroule dans la moelle osseuse où elles ont été produites. Pour leur part, les cellules T migrent vers le thymus pour assurer leur maturation.
Les cellules B et T maturées vont ensuite gagner les ganglions où les cellules T vont entrer en contact avec les cellules dendritiques.
Les cellules dendritiques ou cellules de présentation des antigènes
Au début des années 70, la façon dont un antigène induisait la synthèse des anticorps par les cellules B était inconnue.

Ralph Steinman (1943-2011), Université Rockfeller, New York, Prix Nobel 2011
En 1973, Ralph Steinman identifia dans la rate et les ganglions lymphatiques un nouveau type de « globules blancs » pour lequel il proposa le terme de cellules dendritiques (du grec dendron, arbre), car elles présentent des prolongements cellulaires évoquant une arborescence. Il obtiendra le Prix Nobel en 2011. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2139237/pdf/1142.pdf
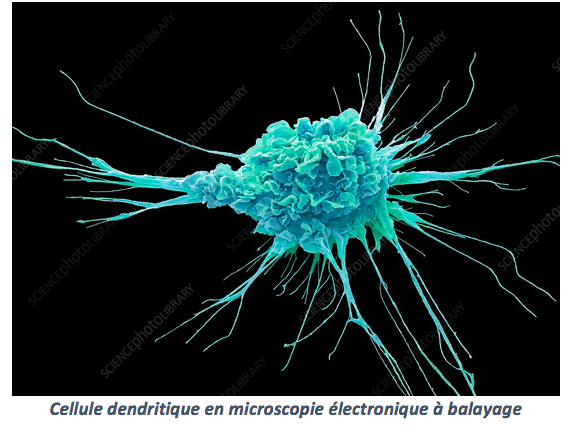
Ce travail constitua le départ d’une série d’études sur les cellules dendritiques. Techniquement, elles sont difficiles à repérer, car elles ne représentent que 0,2% des globules blancs, lesquels ne représentent que 1% des cellules sanguines.
Peu à peu, les éléments du puzzle se mirent en place. Il apparut que ces cellules capturaient les antigènes, les fragmentaient et les présentaient aux cellules T. Elles font partie du groupe des Cellules Présentatrices d’Antigènes (CPA).
Elles sont présentes dans tout l’organisme et prédominent largement dans la peau, les muqueuses ( nez , bronches , tube digestif ) et dans tous les tissus entourant les organes.
Après capture des antigènes dans les tissus infectés ou après une vaccination, elles migrent vers les ganglions et assurent la présentation des antigènes aux lymphocytes T issus du thymus.
Le schéma ci-dessous illustre le cheminement des cellules dendritiques vers les ganglions lymphatiques, après capture des antigènes au niveau de la peau. Les cellules de Langerhans présentes dans l’épiderme sont des cellules dendritiques. Elles furent découvertes par Paul Langerhans au 19ème siècle, mais à l’époque leur rôle demeurait totalement inconnu.
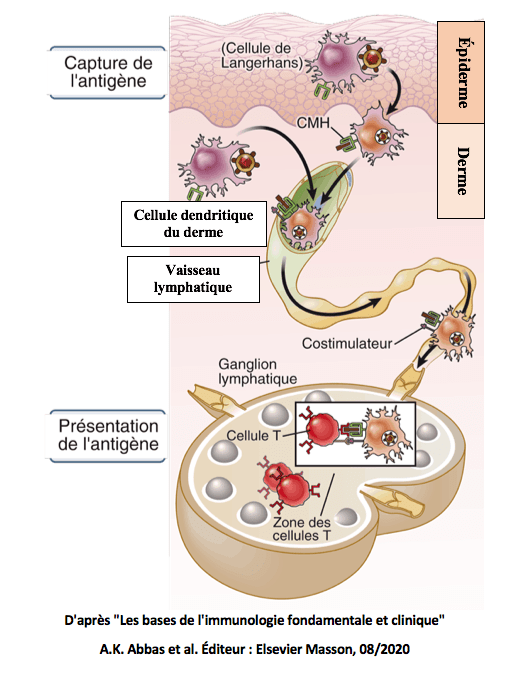
Les cellules dendritiques étant réparties dans l’ensemble des tissus, elles jouent un rôle de sentinelles et repèrent tout élément étranger.
Lors d’une vaccination, les cellules dendritiques présentes au niveau de la zone d’injection vont capter l’antigène, le découper, le présenter à leur surface sous forme de fragments et migrer vers les ganglions lymphatiques.
Ainsi, dans le cadre des vaccinations actuellement pratiquées, l’information antigénique initialement présente dans le muscle de l’épaule va être diffusée dans tout l’organisme, via ces cellules dendritiques.
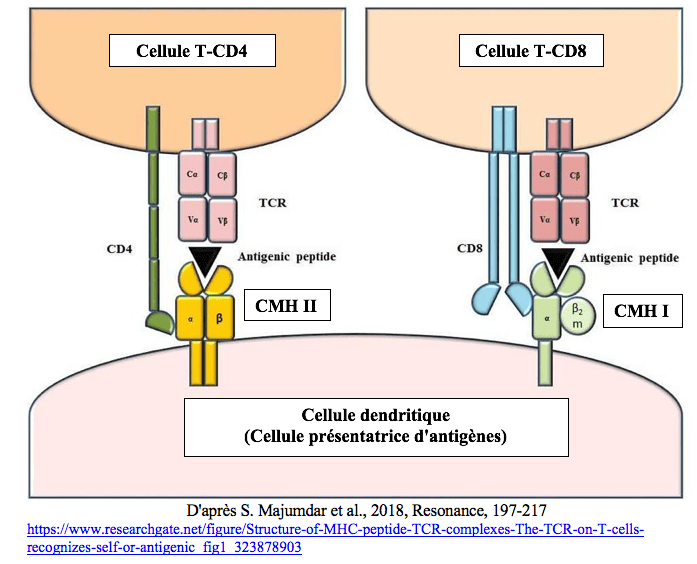
Les cellules dendritiques possèdent deux types de présentoirs à antigènes dénommés CMH I et CMH II (Complexes Majeurs d’Histocompatibilité I et II).
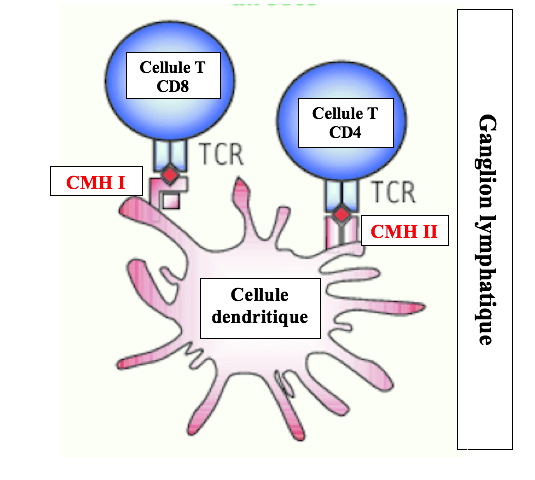
Au niveau des ganglions lymphatiques, les cellules dendritiques se lient à deux types de cellules T provenant du thymus, les cellules T-CD8 portant un récepteur TCR et un co-récepteur CD8 et les cellules T-CD4 portant un récepteur TCR et un co-récepteur CD4.
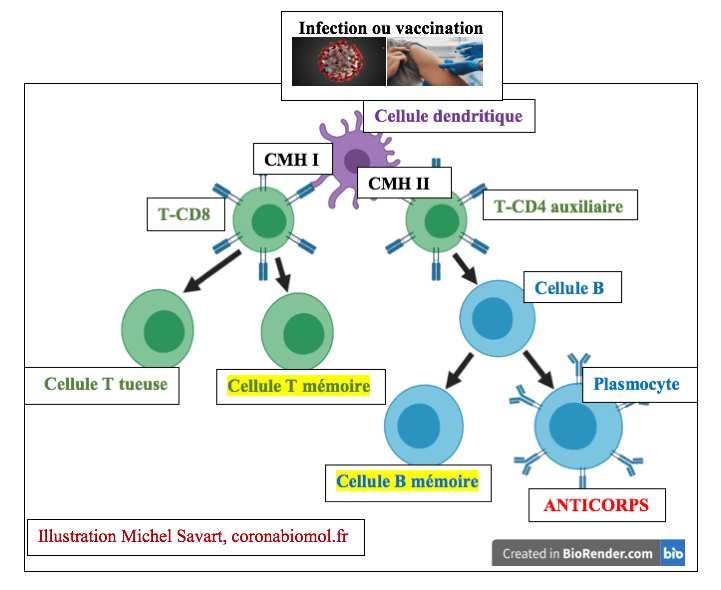
De la cellule dendritique aux cellules mémoires
Les cellules T-CD4 et T-CD8 jouent des rôles très différents.
T-CD4, Anticorps et cellules B mémoires
Les cellules T-CD4 dites auxiliaires (en anglais T helper ou Th) sécrètent des médiateurs chimiques (cytokines) qui entrainent la transformation des cellules B issues de la moelle osseuse en plasmocytes et en cellules B mémoire. Lors d’une infection ou d’une vaccination, ce processus de transformation peut prendre de quelques jours à quelques semaines. Il s’agit de la réponse immunitaire primaire générée par la première rencontre des cellules dendritiques avec l’antigène.
– Durant cette première phase les plasmocytes sécrètent des anticorps qui disparaissent au bout de plusieurs semaines. A ce stade, les anticorps produits, principalement de type IgM, ont une affinité moyenne pour les antigènes. Les plasmocytes sont éliminés après disparition des antigènes.
– Les cellules B mémoires se forment également à partir des cellules B. A la différence des plasmocytes, les cellules B mémoire vivent durant des dizaines d’années. Lors d’une réexposition à un même antigène ces cellules mémoire se réactivent et sécrètent des anticorps de haute affinité permettant de neutraliser rapidement l’agent infectieux.
Les grandes lignes de la mémoire immunitaire
T-CD8, Cellules T tueuses et cellules T mémoires
– Les cellules T tueuses issues des T-CD8 détruisent les cellules tumorales ou celles infectées par des virus. Comme détaillé dans l’article précédent, les cellules tumorales ou infectées par des virus se comportent comme des cellules présentatrices d’antigènes. A la différence des cellules dendritiques, elles ne possèdent que le présentoir CMH I. Ces cellules T tueuses ont une durée de vie éphémère, elles disparaissent à l’issue de l’infection.
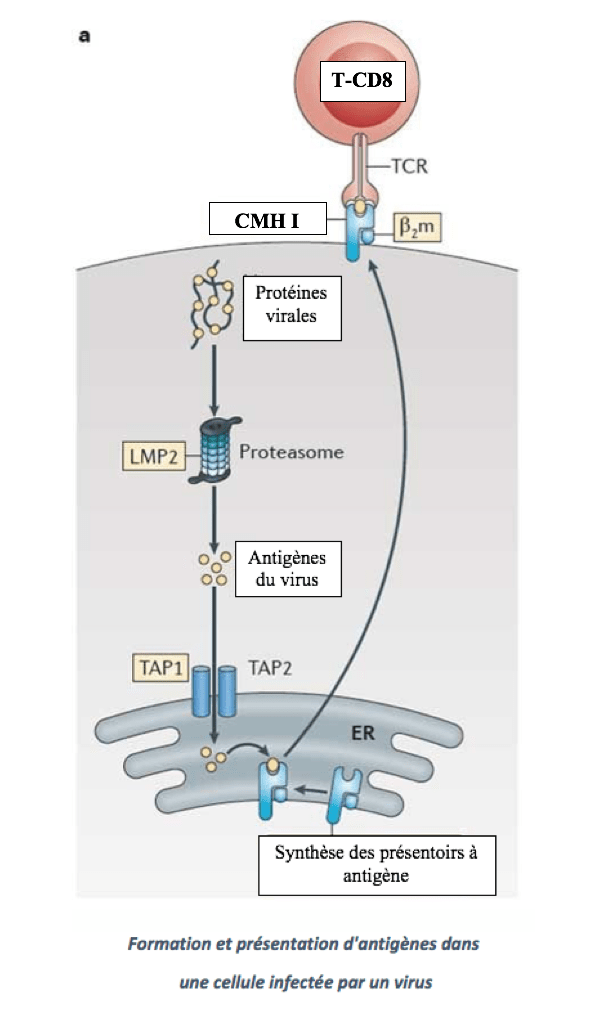
– Les cellules T mémoires conservent l’empreinte des différents antigènes rencontrés lors de précédentes infections ou lors de vaccinations. A la différence des cellules T tueuses elles se maintiennent dans l’organisme durant des dizaines d’années et sont réactivées lors d’une nouvelle infection. Elles donneront alors naissance à de nouvelles cellules T tueuses.
Décryptage de l’immunité à long terme : les implications
Après plus d’un siècle de recherches, il est finalement apparu que l’immunité à long terme reposait sur la présence de deux grands types de cellules mémoires qui persistent dans l’organisme durant de nombreuses années :
– Les cellules mémoires B qui génèrent les anticorps.
– Les cellules mémoires T qui détruisent les cellules infectées par un virus, suite à la présentation des antigènes d’origine virale.
Ces résultats ont modifié l’approche que nous avions jusqu’alors des maladies virales et de la conception des vaccins.
Désormais, dès l’apparition de nouvelles souches virales, la présence des cellules mémoires B et T est recherchée chez des patients infectés ayant fait face à la maladie.
Une étude réalisée en 2020 a montré que des patients ayant contracté la maladie lors de l’épidémie asiatique de coronavirus de 2003 possédaient des cellules T mémoires 17 ans après leur infection. https://www.nature.com/articles/s41586-020-2550-z
S’agissant des souches de coronavirus actuelles le recul est évidemment moindre. Cependant, la présence de cellules B mémoires chez des patients ayant eu des formes sévères ou modérées de la maladie a été détectée jusqu’à six mois après l’infection. https://www.cell.com/cell/fulltext/S0092-8674(21)00093-3
De ce fait, lors de l’élaboration de nouveaux vaccins, leur capacité à induire la formation de cellules mémoires de la même manière que lors de l’infection naturelle est systématiquement étudiée.
Dans cette optique et dès 1993, un groupe de chercheurs français travaillant à la mise au point d’un vaccin antigrippal montra qu’un ARN messager encapsulé induisait la formation de cellules T. https://onlinelibrary.wiley.com/doi/abs/10.1002/eji.1830230749
Les vaccins à ARN messager actuellement utilisés ont fait l’objet du même type d’études. Ainsi, le vaccin Pfizer/BioNTech provoque une réponse immunitaire due à des cellules T-CD4 auxiliaires et T-CD8. https://www.nature.com/articles/s41586-020-2814-7
Pour aller plus loin
F. Gros, S. Fournel, S. Liégeois, D. Richard, P. Soulas-Sprauel, Atlas d’immunologie, Collection Sciences Sup, Dunod, 2018.